

第1回分類 第1回詳細1 第1回詳細2 第2回培養細胞 第2回詳細 第3回メダカ 第3回詳細 第4回遺伝子組み換え 第4回詳細
特別編1培養細胞 特別編2ウニのクローン 総合学習①GFP 総合学習②クロマト 総合学習③電気泳動 生物ⅡラムダDNA解
2月18日(金)・3月4日(金)
ここからはラムダDNA解析でも使用したフィールドテストに使った電気泳動装置と試薬のキットを使いました。
アクリルアミドやアガロース(寒天)のゲルに試料を入れ、電圧をかけます。試料がマイナスの電荷を帯びていれば+極へ、プラスの電荷を帯びていれば-極へ移動します。
移動速度は試料の電荷の大きさと、試料の分子の大きさによって決まります。
電荷が大きければ試料にかかる力が大きくなりはやく移動します。試料の分子が大きければゲルに引っかかりやすくなり移動速度は小さくなります。
SDS-PAGEとは電気泳動によって、主にタンパク質の分子量を決める方法です。
タンパク質はマイナスの電荷を持ちます。しかし、種類によってその強さはまちまちです。
SDSと呼ばれる界面活性剤(食器洗い用洗剤の主成分)をタンパク質に作用させると、タンパク質の種類にかかわらず、同じ強さのマイナスの電荷を持たせることが出来ます。
タンパク質はポリペプチドと呼ばれるひも状の分子が、球状に絡まり合った状態になっています。タンパク質の種類によって絡まり方が異なるので、同じ分子量のタンパク質でも電気泳動をしたときの移動距離が同じにはなりません。
SDSを加えた後、加熱をすると絡まりがほどけてひも状になると考えられます。
SDSを加えて加熱をすることで、電荷の大きさを一定にして、さらに分子の形もそろえてることができます。
そのために、電気泳動をしたときの移動距離から、分子量を求めることが出来るようになります。
使用するゲルは、ポリアクリルアミドと呼ばれる物質で出来ている厚さ1mmのゲルを二枚のガラス板にはさんだものです。
ゲルの上部を濃縮ゲルと呼ばれる濃度の低いゲル、下部を分離ゲルと呼ばれる濃度の高いゲルにすることで、大変精度が高い電気泳動を行うことが出来ます。
電気泳動の準備をしています

加熱してもフタが飛ばないように、パッキング付きのスクリューキャップ付きのチューブにサンプルを入れ、SDSバッファーを加えました。さらに95℃で5分間加熱をします。
この操作でタンパク質は一定の電荷を持ち、ひも状になると考えられます。
サンプルは次の6種類を準備しました。
加熱はナベで行います(左)


スラブ型の電気泳動装置です。JSTの科学館学校連携事業で試作したものを利用しました。(右)
ゲルにサンプルを入れています。 ゲルにサンプルがうまく入りました。(左)


ゲルにサンプルをロードしました。サンプルには青い色素が入れてあるのでよく見えます。
上を-極、下を+極にして最大300Vの電圧をかけます。(右)
電圧をかけると電極から泡がでます。マイナスの電荷を持つタンパク質は下に向かってゲルの中を移動します。サイズの小さいタンパク質ほどはやく移動します。
青い色素は、もっともサイズの小さいタンパク質と同じぐらいの早さで移動します。
電気泳動中・通電すると泡がでます
青い色素がゲルの下の方まで来たら終了です。(左)


電気泳動装置からゲルをはずしました。(右)
タンパク質は無色であるためにゲルを見てもタンパクを確認することは出来ません。
ゲルはクマシーブルーと呼ばれる染色液で1時間ほど染色をしました。
その後脱色液に一晩浸します。下の写真は脱色中のものです。

脱色液はメタノールに酢酸を加えて液を水で薄めたものです。ラップをかけて揮発を防ぎます。
サンプルの種類と記号を示したものです(左)

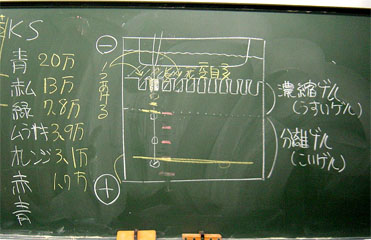
KSの色と分子量 ゲルの使い方を示した板書です(右)
染色したゲルをライトボックスに置いて観察し、デジカメで写真を撮ります。
ライトボックスにラップをひいてゲルを載せます。

一番きれいに出来た4班のゲルです。

電気泳動はうまくいき、きれいなバンドが確認できました。
クロマト前のサンプルとクロマト後のサンプルもたくさんのバンドが確認でき、どれがGFPなのかよくわかりません。
調べてみるとGFPの分子量は27,000です。KSの上から5番目の赤いバンドが31,000(写真の燈3.1万)なので、ほぼ同じ位置にある濃い色のバンドがGFPであると考えられます。それ以外のバンドは不純物と考えられます。
クロマト前と後のサンプルのバンドを比べると、特に違いがありません。
クロマト後のほうが前のサンプルと比べてGFPのバンドが濃い、あるいはGFP以外の不純物のバンドが薄いと見ることは出来ません。
したがって、電気泳動の結果から見るとGFPの精製はうまくいっていないと見ることが出来ます。
最初の2回は講義が中心であったこともあり、生徒のモチベーションも思ったほど高くなく先行きが心配でしたが、回を重ねるごとに、前向きに取り組むようになりました。
マイクロピペットや遠心機などの扱いもすぐに習熟しました。
また、実験操作の意味や原理についてはかなり理解したと思われます。
また、特別な実験をしているという意識はかなり持ったようで、そのことが集中して取り組む要因になったようです。
後半は、多くの生徒が金曜日の午後(総合の時間)を楽しみにしているようでした。
やや高度な内容であっても実験操作や、実験の原理の理解は思ったより出来たと思われます。
しかし、関連した理論や、応用的な実験の発展的な内容に関しては理解は不十分であると感じました。
生徒と話の中で「この実験はどんなことに利用できるのか。」とか「こんな事はわかっていないのか。」と言った質問はほとんどありませんでした。
もっとも、彼らにとって新しいことばかりで、目の前の実験を理解するのに手一杯で、余裕がなかったのかもしれません。
本来、生物Ⅱで行う内容を1年生に対して行ったので理論的な理解を求めるべきではないのかもしれません。
同じ内容を同じ時間(16時間以上)をかけて3年の生物Ⅱで行ったら面白いと思います。しかし、これだけの時間をかけることは現実には困難です。
しかし、予備知識のない1年生に対してバイオの実験は十分に可能であることがわかりました。
GFPの精製の実験(BIORAD キット2)は初めて行いましたが、GFPがブラックライトで見えるため、精製されていく様子がよく見え、インパクトのある実験が出来ました。
また、週1回の授業であるため、実験の途中で止めて後は来週となります。
その間のサンプルの保存方法や、実験をどこで止めるのがよいのか等、マニュアルには書いていない疑問についてBIORADの担当者にアドバイスを受けました。この場を借りてお礼申し上げます。
タンパク質電気泳動(SDS-PAGE)は、電気泳動そのものはうまくできましたが、良い結果が出ませんでした。
カラムクロマトグラフで精製前のサンプルと精製後のサンプルでバンドが同じで、精製しても不純物が減っていないと言う結果でした。
今後に向けて
タンパク質の研究はポストゲノムと呼ばれ今後のバイオテクノロジーの重要な分野です。
タンパク質の電気泳動はDNAより技術的には難しいのですが、DNAと異なりサンプルの入手が簡単で、PCRのような高校では困難な操作が必要ないため、ぜひ授業に取り入れてみたいと考えています。
第1回分類 第1回詳細1 第1回詳細2 第2回培養細胞 第2回詳細 第3回メダカ 第3回詳細 第4回遺伝子組み換え 第4回詳細
特別編1培養細胞 特別編2ウニのクローン 総合学習①GFP 総合学習②クロマト 総合学習③電気泳動 生物ⅡラムダDNA解析